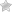Пример 1: Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): 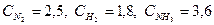 . Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
. Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
Определяем константу равновесия Кс этой реакции:
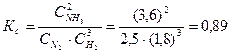
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, а для получения 3,6 моль аммиака требуется 3∙3,6/2 = 5,4 моль; учитывая равновесную концентрацию водорода, находим его исходную концентрацию:
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4,3; С(H2) = 7,2.
Пример 2: Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А+В = 2C. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции Кс =50.
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через x моль, то увеличение концентрации вещества С будет равно 2x моль.
Равновесные концентрации реагирующих веществ будут: [A] = (0,5-х) моль/л; [B] = (0,7-х) моль/л; [С] = 2х моль/л.
Кс = 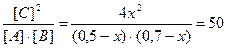
Решая это уравнение, получаем: x1 = 0,86; x2 = 0,44. По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: [A] = (0,5-0,44) = 0,06 моль/л; [B] = (0,7-0,44) = 0,26 моль/л; [С] = 0,44∙2 = 0,88 моль/л.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9975 —  | 7768 —
| 7768 —  или читать все.
или читать все.
91.146.8.87 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Зная величины констант равновесия и используя стехиометрические соотношения реакции (закон сохранения массы), рассчитывают равновесный состав продуктов по следующей схеме.
Пишут уравнение реакции.
2. Пишут под формулами уравнения начальные концентрации исходных веществ (в моль/л). Если начальные концентрации продуктов реакции не оговариваются в условии задачи, они обычно принимаются равными нулю.
3. Принимают, что в ходе реакции до состояния равновесия прореагировало x моль/л какого-либо вещества. Обычно за x принимают изменение концентрации того реагента, стехиометрический коэффициент при котором в уравнении реакции наименьший, чтобы избежать дробных коэффициентов при неизвестном x. Например, прореагировало x моль/л вещества А.
4. По уравнению реакции определяют изменение концентраций других веществ.
5. Определяют равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
по уравнению 1 b c 1
6. Пишут выражение закона действующих масс. Подставляют в него найденные значения равновесных концентраций.
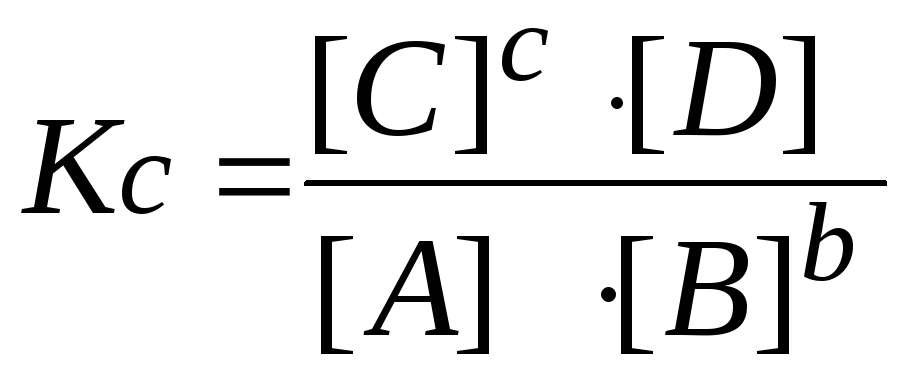 ,
,
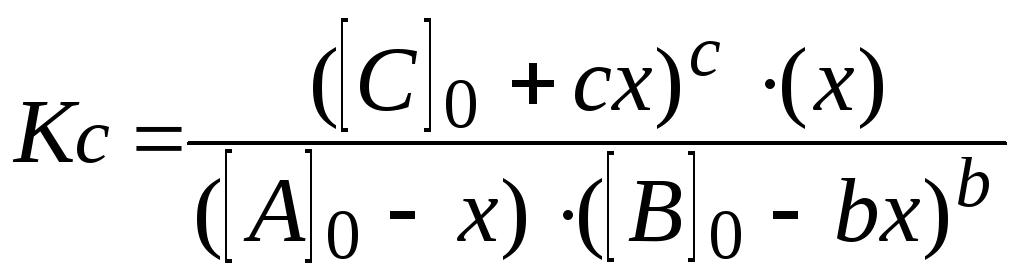
7. Решают уравнение. При этом учитывают, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации (начальная концентрация исходного вещества не может быть меньше его остаточной равновесной концентрации).
Находят равновесные концентрации.
4. Смещение химического равновесия. Принцип Ле Шателье
Истинное химическое равновесие является динамическим и подвижным: изменение внешних условий (температуры, давления, концентраций реагирующих веществ) ведет к смещению равновесия в сторону прямой или обратной реакции.
Характер влияния внешних факторов на равновесные системы выражает принцип Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия.
4.1. Изменение концентраций
Равновесное состояние в системе
характеризуется (для одной и той же температуры) константой равновесия:
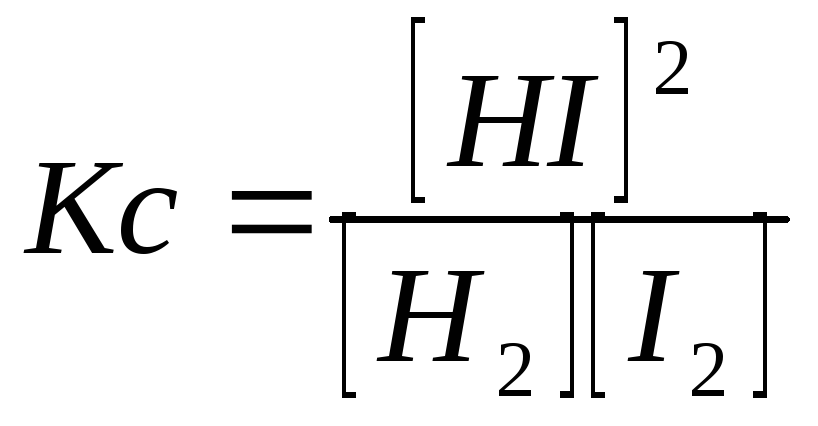 .
.
Если, например, в систему добавить водород, т.е. увеличить его концентрацию, то скорость прямой реакции увеличится (в соответствии с законом действующих масс):
 пр = kпр [H2] [I2],
пр = kпр [H2] [I2], 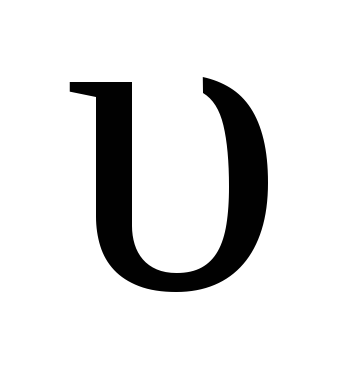 пр
пр  обр,
обр,
равновесие сместится вправо. Концентрация йодоводорода будет увеличиваться, а концентрация водорода и йода будет уменьшаться. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут другими, но соотношение между ними, определяемое константой равновесия, останется постоянным.
Если в систему ввести дополнительное количество йодоводорода, то скорость обратной реакции увеличится:
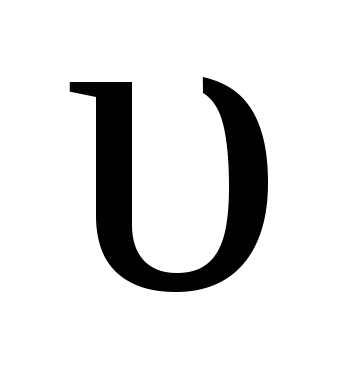 обр = kобр [HI] 2 ,
обр = kобр [HI] 2 , 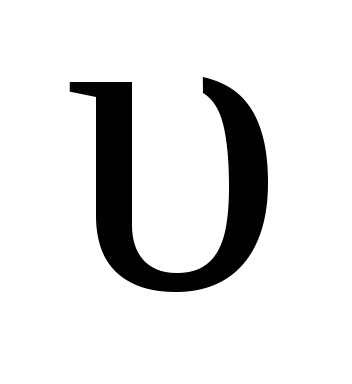 обр
обр 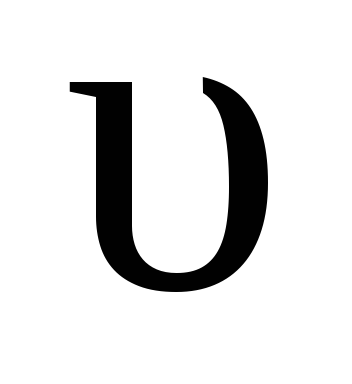 пр ,
пр ,
равновесие сместится влево.
В соответствии с принципом Ле Шателье:
— при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества;
— при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Удаление из системы продуктов (или продукта) реакции ведет к смещению равновесия в сторону прямой реакции, а уменьшение концентрации исходных (или исходного) веществ, приводит к сдвигу равновесия в направлении обратной реакции.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.