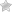Гидроксид натрия :: Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH ), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ:
- c кислотами — с образованием солей и воды:
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH + H3O + → 2H2O.)
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
так и с растворами:
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- С амфотерными гидроксидами:
2. Обмена с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, помимо этого избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
3. С неметаллами:
к примеру, с фосфором — с образованием гипофосфита натрия:
2NaOH + Cl2 → NaClO + NaCl + H2O(дисмутация хлора)
2Na + + 2OH + 2Cl → 2Na + + 2O 2 + 2H + + 2Cl → NaClO + NaCl + H2O
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al 0 + 2Na + + 8OH + 6H + → 3H2 + 2Na + [Al 3+ (OH) 4]
5. С эфирами, амидами и алкилгалогенидами (гидролиз):
с жирами (омыление), такая реакция необратима, поскольку получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, исходя из состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
Ответ или решение 1
![]()
Определим с какими из заданных соединений может реагировать гидроксид натрия. Запишем уравнения реакции.
1. Реакция с оксидом кальция. В результате образуется оксид натрия и гидроксид кальция.
2. Реакция с оксидом серы. В результате образуется сульфит натрия и вода.
3. Реакция с хлоридом бария. В результате образуется хлорид натрия и гидроксид бария.
4. Реакция с сульфатом меди. С образованием гидроксида меди и сульфата натрия.
Изучаем свойства щелочей на примере гидроксида натрия. Итак, гидроксид натрия взаимодействует с какими классами неорганических веществ. Надо привести примеры и записать уравнения реакций.
Гидроксид натрия (едкий натр, каустическая сода, каустик) в обычных условиях представляет собой гигроскопичные кристаллы белого цвета, плавящиеся без разложения. Хорошо растворяется в воде (при этом выделяется большое количество теплоты) создавая сильнощелочную среду. Сильно снижает растворимость многих солей натрия в воде. Не растворяется в жидком аммиаке.
Гидроксид натрия проявляет свойства основных гидроксидов (относится к щелочам), т.е. нейтрализуется кислотами, реагирует с кислотными оксидами. Поглощает диоксид углерода из воздуха. Гидроксид натрия взаимодействует с неметаллами, металлами, амфотерными оксидами и гидроксидами.
Реакции взаимодействия кислот со щелочами называются реакциями нейтрализации. В результате взаимодействия образуется соль и вода. Гидроксид натрия реагирует как с разбавленными, так и с концентрированными растворами кислот:
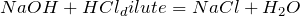 ;
; 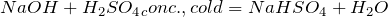 ;
; 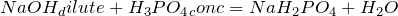 .
.
Взаимодействие гидроксида натрия с простыми веществами неметаллами, например, галогенами, протекает по следующим схемеам:
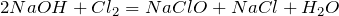 ;
; 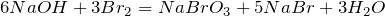 .
.
Реакции взаимодействия с металлами протекают при нагревании до температуры выше 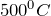 и одним из продуктов обязательно является оксид этого металла:
и одним из продуктов обязательно является оксид этого металла:
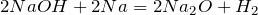 ;
; 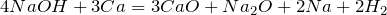 .
.